用人类多能干细胞创造种间嵌合体为模拟人类发育和产生供体器官提供了一个有希望的策略;然而,人类细胞整合不良仍然是一个主要障碍。大多数现有的改善人类嵌合体的努力集中在对供体hPSCs进行基因修饰,而改变宿主胚胎在很大程度上仍未被探索。
2025年11月24日,德克萨斯大学西南医学中心吴军、深圳华大生命科学研究院顾颖共同通讯在Cell在线发表题为“RNA innate immunity constitutes a barrier for interspecies chimerism”的研究论文,该研究表明RNA先天免疫构成了种间嵌合的障碍。
在这里,研究人员使用种间PSC竞争模型,发现“胜利者”小鼠细胞中的RNA先天免疫驱动hPSCs的竞争性消除。破坏RNA感应途径降低了小鼠PSCs的竞争力和生存能力,缺乏Mavs(RNA先天免疫的关键基因)的小鼠胚胎导致人类细胞存活率和嵌合体显著提高。研究人员还发现,接触依赖的水平RNA转移可能是这种免疫激活的基础。总的来说,该研究揭示了RNA先天免疫在细胞竞争中以前未被认识到的作用,并证明了靶向宿主免疫途径是改善动物体内人类嵌合体的有力方法。

使用人类多能干细胞(hPSCs)生成种间嵌合体为研究人类发育、创建人源化动物模型以及通过胚泡互补实现器官生成提供了一个强大的平台。虽然在亲缘关系较近的物种之间可以实现强大的嵌合体,但由于早期发育过程中的异种障碍,远缘物种之间的整合仍然效率低下。这些障碍包括发育时间的不匹配、细胞粘附不相容以及种间PSC竞争。以前增强人类细胞贡献的策略主要集中在通过基因修饰阻断供体hPSCs的凋亡,但这些方法一种更安全且可能更具翻译相关性的策略是通过遗传修饰宿主胚胎而不是改变供体细胞来改善人类嵌合体。
近年来,旨在突破异种屏障的策略主要聚焦于改造供体,即对人类细胞进行遗传修饰来抑制其凋亡,如敲除P53或过表达BCL-2。尽管可以提升嵌合率,但赋予人类细胞“抗凋亡”特性在再生医学转化中存在巨大的安全风险。因此,如果能通过改造宿主来提高嵌合率,将是更为理想且安全的策略。
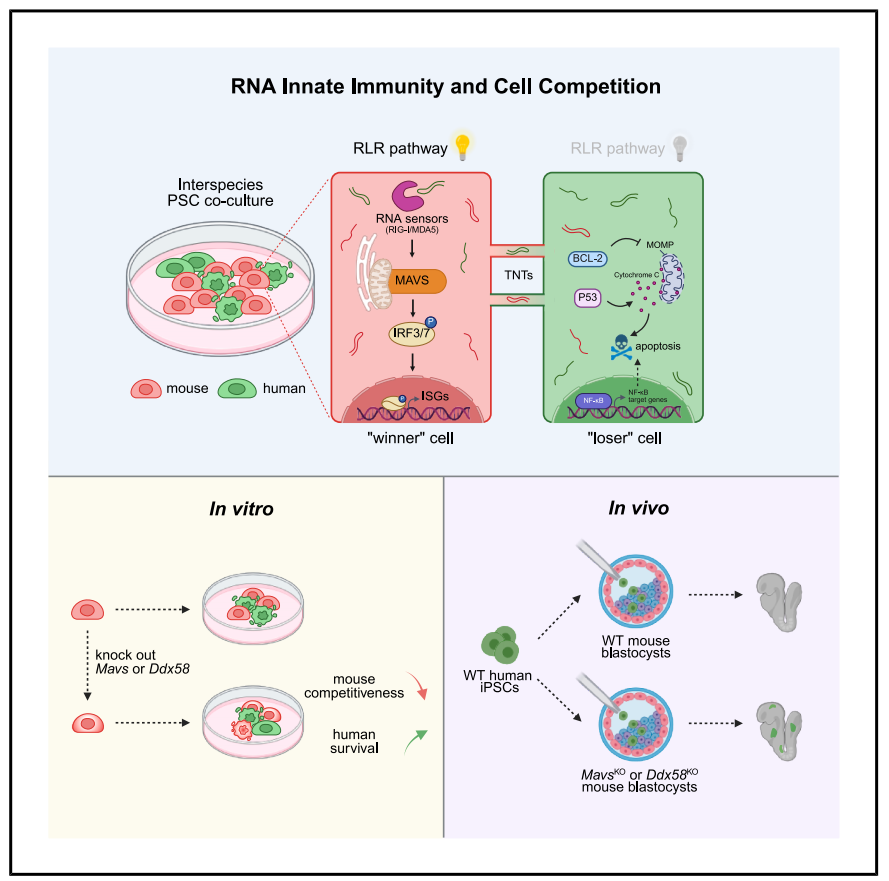
机理模式图(图源自Cell)
该研究首次发现在人类和小鼠多能干细胞共培养中,跨物种RNA交换可激活小鼠细胞的RNA天然免疫通路,进而介导细胞竞争清除人类细胞。敲除通路关键蛋白(RIG-I/MAVS)能够削弱小鼠细胞的竞争力,在不修饰人类细胞的前提下显著提升其存活率和在小鼠胚胎中的嵌合率。这一发现揭示了异种屏障和细胞竞争的新机制,为再生医学提供了更具安全性的“宿主改造”新范式。
https://www.cell.com/cell/fulltext/S0092-8674(25)01244-9























热门跟贴