作者:王川
2025年诺贝尔生理学或医学奖授予了Shimon Sakaguchi、Mary E. Brunkow和Frederick J. Ramsdell。诺贝尔奖委员会评价说:“他们的发现为免疫调控研究奠定了基础,并推动了针对癌症和自身免疫病的新型疗法开发。”今天,就由小爱陪大家走近这项诺奖成果——他们到底发现了什么呢?
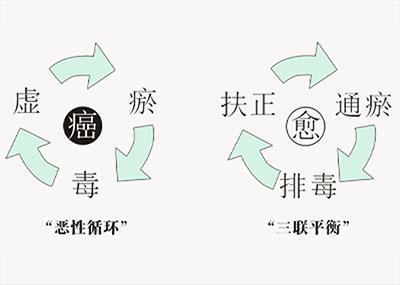
我们的免疫系统每天都在上班打怪:一边对付细菌病毒,一边巡逻有没有“变坏的自己人”。最大原则就两条:别放过真敌人,也别错杀自己人。像红斑狼疮、类风湿关节炎,就是典型翻车——本来负责保家卫国的免疫细胞,结果把关节、血管、肾脏、皮肤当成敌人,久而久之就疼、肿、受损,活生生演成一出“自己人互殴”。
其实,免疫系统有两道“防呆设计”:一套是“中枢耐受”相当于出厂前体检:T细胞、B细胞在胸腺、骨髓里考试,谁对自己人反应太猛,直接淘汰。另一套是“外周耐受”类似上市后的监管:就算有漏网之鱼混到体内,遇到自身成分拿不到完整激活信号,也会疲软、休眠甚至被请下场。再加上调节性T细胞(Treg)这种“维稳小分队”盯着过火的免疫反应,谁打得太猛,就被按住劝冷静。
麻烦在于,一旦这几道防线都失灵,免疫系统就会把“自己人”贴上“敌人标签”,自反应T细胞、B细胞被激活,制造各种自身抗体,和自身成分黏在一起形成“垃圾团”沉在血管、肾小球、皮肤里,或者细胞成堆挤进关节和器官。补体、炎症因子、中性粒细胞、巨噬细胞一拥而上“收拾战场”,但战场就是自己身体。
于是就出现了反复的“炎症—修复—再炎症”,组织结构一点点被磨坏,功能越来越差。所以,真正伤人的,不是偶尔一下“打自己”,而是长期慢性、反复的自伤性炎症。
早在20世纪50年代,Burnet提出“克隆选择学说”:人从胚胎到新生儿阶段,淋巴细胞要在胸腺、骨髓里上“自我识别课”,会误伤自己的细胞会被清除,从而建立免疫耐受。
随后Medawar团队在胚胎期/新生期输入他系免疫细胞,发现长大后可以接受同源皮肤移植,用实验把这套理论坐实。此后,Sakaguchi把这套“别打错自己人”的机制具体到了细胞和基因层面:他先在新生小鼠去胸腺模型中发现,只要补回一类特殊T细胞(后来用 CD25+CD4+标记),就能压住自身免疫,2000 年正式把这群细胞命名为调节性T细胞(Treg)。
与之对应的基因“总开关”是Foxp3(小鼠为Foxp3,人类为FOXP3,文中统称Foxp3):2001 年Brunkow和Ramsdell在自身免疫小鼠和 IPEX 患儿中发现Foxp3致病突变,2003年又证明缺失Foxp3的小鼠几乎不能产生正常Treg,很快出现致命性全身反应。
由此形成一条清晰的链条:Foxp3→Treg→外周免疫耐受。正因为他们把这条从“理论—细胞—基因”的通路完整拼好,奠定了免疫调控和相关治疗的基础,因此三位学者共同获得 2025 年诺贝尔生理学或医学奖。

图片来源:作者提供
1
为什么有人对PD-1/PD-L1起效短、
复发快?
从“免疫温控”的角度看,之所以有人对免疫治疗“来得快、去得也快”,往往是五股“冷意”在作祟:
第一,没热源:肿瘤能暴露给免疫系统的“把柄”太少,突变不多、信号不强,好比炉膛里柴火稀,火苗刚起就熄。
第二,看不见:肿瘤不“举身份牌”,呈递分子缺位,树突状细胞也不给力,免疫细胞纵有战意也认不出敌我。
第三,进不来:肿瘤周围血管乱、基质硬,仿佛城门紧闭,外头热闹、里头发凉。
第四,杀不动:肿瘤换上一套“备用刹车”,同时把微环境搞得又酸又缺氧、能量见底,T细胞有点跑到力竭。
第五,全身因素与演化:身体底盘功率本就偏低(长期激素、频繁广谱抗生素、营养体能差),再加上肿瘤“改换门庭”(敏感克隆被清,耐受克隆接班),就容易早复发或少数灶点冒头。
2
从“冷”到“热”:肿瘤微环境(TME)的差异决定初始与持续应答
“冷”型肿瘤微环境,大体就是:CD8+T细胞和cDC1(conventional dendritic cell type 1,1型树突状细胞)少、趋化因子CXCL9/10信号弱、血管在VEGF影响下又歪又堵还缺氧,再叠加Treg、MDSC(myeloid-derived suppressor cell,髓源性抑制细胞)等抑制成分居多,免疫细胞既不容易进来,也很难真正发动、维持攻击。
“热”型TME则表现为CD8+T细胞密度高、cDC1充足、干扰素IFN-γ和抗原呈递通路顺畅、抑制细胞相对较少,更利于免疫治疗起效和维持,但“冷→热”之后如果Treg、代谢抑制和缺氧血管再次占上风,战场仍可能慢慢“再变冷”,疗效随之打折。

图片来源:作者提供
3
为何不宜寄望免疫单药起步?
对于EGFR阳性的肺腺癌患者来说,初治时这类肿瘤多处在一种免疫被压低的肿瘤微环境里:肿瘤中负责正面“清除”的CD8+T细胞数量偏少,反而是调节性T细胞(Treg)、骨髓来源抑制性细胞(MDSC)等抑制性细胞占上风;同时,EGFR突变肿瘤还会分泌TGF-β、IL-10、VEGF、腺苷等多种因子,让NK细胞迟钝、树突状细胞(DC)不成熟,抗原呈递和细胞毒性T细胞的持续杀伤能力都打折扣。
就像“冷肿瘤”仅靠PD-1/PD-L1这一条通路,很难把整体免疫反应真正“带起来”,临床上表现就是:单用免疫检查点抑制剂,起效率和维持时间往往都不理想。
4
EGFR-TKI治疗后、耐药阶段,肿瘤微环境会“重塑”
EGFR-TKI治疗后进入耐药期,并不只是“药不灵了”,而是肿瘤和免疫系统长期拉锯后,肿瘤微环境在细胞构成、信号分子、代谢和血管状态等方面都在悄悄“改造”,这些变化会直接关系到后面还能不能抓住免疫或联合治疗的机会窗口。
EGFR-TKI(如奥希替尼)治疗一段时间后,肿瘤细胞表面PD-L1常见上调,部分患者 TMB(肿瘤突变负荷)显著升高;耐药阶段可见CD8+TIL密度上升,在EGFR非T790M人群中还有报道提示 FOXP3+Treg反而减少,提示局部免疫活性被部分“唤醒”,就有可能变成“热肿瘤”。
一项回顾性研究在138例EGFR非T790M、EGFR-TKI耐药NSCLC中发现 FOXP3+Treg 减少、PD-L1 升高、CD8+TIL 增多;另一项对327例一线及63例后线奥希替尼治疗患者的配对样本分析显示,治疗后PD-L1和TMB均显著上调;还有研究比较EGFR-TKI耐药后二线联合免疫治疗与标准化疗,发现TKI阶段PFS较长的患者,其后续样本呈现更高的CD3+/CD8+/IFN-γ+CD8+浸润和更低的M2样巨噬细胞水平,呈现出更“免疫活跃”的表型。
整体提示:耐药期的TME并非一律“更冷”,部分患者反而出现“冷转稍热”,为免疫联合方案预留了潜在切入口。

图片来源:包图网
5
作为患者,我们最关心的是:
有哪些“看得见”的信号,可能和免疫起效不久、维持不长有关?
1
大致可以分为组织(肿瘤标本)
和全身层面的检测指标:
1、CD8+TIL 密度(免疫组化/IHC,或数字病理):评估杀伤T细胞是否“到场”。
2、Treg/MDSC比例:Treg常用FOXP3(IHC/流式);MDSC多用流式表型(如 CD11b+CD33+HLA-DR^low),临床常作为参考而非单独决策。
3、PD-L1表达(IHC,TPS/CPS报告):提示肿瘤是否“启用”检查点通路。
4、TMB(肿瘤突变负荷)(NGS组织或血浆ctDNA):估计潜在新抗原数量。
5、HLA-I/B2M状态(IHC/NGS):呈递链路是否完整;缺失提示即便T细胞在场也“认不出”。不过目前多见于科研或深度评估,普通报告里不常规标出。
6、IFN-γ相关基因特征(RNA 面板/转录组):反映炎症与抗原呈递轴是否被激活。
7、全身因素:近期/长期激素、广谱抗生素使用史,营养与体能状态(体重变化、体能评分),慢性感染/口腔炎症控制情况等。
2
什么时候检测呢?
初治前建立基线;治疗中/耐药或复发时复评(优先原位或进展灶活检,无法活检可用ctDNA +外周免疫学指标)以捕捉“重塑”后的窗口。
6
小爱为大家整理了几组Q&A,帮你快速对照
Q1:做哪项检查最关键?
A:其实没有“唯一关键”的一项,更重要的是组合评估:比如CD8+TIL和Treg/MDS比例一般依托肿瘤组织(手术或穿刺标本),通过免疫组化或多重免疫荧光在切片上计数,有条件的中心还可用流式细胞术等对新鲜组织或外周血分析免疫细胞亚群,从而判断“杀手T细胞够不够、抑制性细胞是不是太多”;在此基础上,再结合PD-L1表达、TMB、HLA-I/B2M完整性、IFN-γ相关基因特征等分子检测结果,并叠加影像学评估及必要时的重复活检或ctDNA动态监测,把“有哪些免疫细胞”“分子标志物怎样”“随时间怎么变”这些信息拼在一起,才能做出相对更可靠的判断。
Q2:肿瘤复发/进展以后,还能不能用(或再用)免疫治疗?
A:可以,但要先分清是哪种复发,再看复评结果。手术/放化疗后首次远处复发,如果PD-L1升高、CD8+TIL增多、Treg/MDSC下降,且抗原呈递通路基本完整,更适合把免疫或免疫联合作为一线方案;靶向药耐药进展时,多数为“冷”微环境,一般以下一代靶向或化疗±免疫为主,是否加免疫要看PD-L1、TMB及CD8+TIL/Treg/MDSC格局;若是已经用过免疫后再次进展,简单“原配重来”价值有限,只有在复评提示PD-L1、CD8+TIL上升且抑制成分下降、呈递通路好转时,才会考虑在新方案中慎重再联合免疫。
Q3:PD-L1很高但还是很快复发,为什么?
A:PD-L1只是一个信号,不是全部。 可能因Treg/MDSC/M2占优、HLA-I/B2M 缺失或JAK1/2/IFN-γ通路异常、腺苷/乳酸/缺氧等代谢抑制、抗原丢失/变脸(克隆演化)、或肿瘤负荷高/时机不当。
Q4:哪些信号提示“窗口期”可能到了?
A:关键不是死记几个名词,而是用现成的检测套餐,把有利信号拼在一起看。临床上通常先靠病理+免疫组化套餐,在同一块组织上读出PD-L1、CD8、Foxp3 等,了解PD-L1高不高、CD8+TIL多不多、Treg/MDSC有没有“压过头”;再配合NGS免疫评估,一并看到TMB、HLA-I/B2M是否完整,以及IFN-γ相关炎症基因表达谱是不是整体偏高、处于比较“活跃”的表达状态;必要时再用 ctDNA动态检测+影像随访看这些信号是不是持续朝“PD-L1上调+ CD8+TIL增多+ IFN-γ相关炎症基因表达谱偏高,同时HLA-I/B2M基本完整、Treg/MDSC不占优势、代谢抑制不突出”的方向走。当多项指标一起往这个“组合”靠拢时,就意味着免疫治疗的窗口期可能在悄悄打开,值得重点评估。
Q5:我能做什么减少“起效短、复发快”?
A:优化全身与用药环境并按时复评。与医生权衡激素/广谱抗生素使用;改善营养与体能、管理慢性感染/口腔卫生、规律睡眠与戒烟限酒;必要时做再次活检/液体活检以捕捉“重塑”后的最佳介入点。
诺奖把Foxp3-Treg-外周耐受这条主轴点亮了“免疫温控器”,但点火并不等于久燃。对EGFR阳性NSCLC,关键在于识别并主动改造“TME从冷到热”的窗口。免疫单药不是起点,更像拼图中的一块;通过“先整顿后点燃、联合而不盲攻、监测以维持”,把短暂火苗化作可持续的余温,让每一次治疗都尽量对在时机、对在人群、对在组合,朝着更长的缓解与更好的生活质量稳步前行。
参考文献
1.Billingham,RE,BrentL,MedawarPB'.Activelyacquiredtolerance'offoreigncells.Nature.1953,172:603~606.
2.SakaguchiS,TakahashiT,NishizukaY.Study on cellula revents in postthymectomy autoimmune oophoritis in mice.l. Requirement of Lyt-l effector cells for oocytesdamage after adoptive transfer. J Exp Med. 1982, 156:1565~1576.
3.SakaguchiS,FukumaK,KuribayashiK,etal.Organ-specific autoimmune diseases induced in mice by elimination of T cell subset. l. Evidence for the active participation of T cells in natural self-tolerance; deficit of a T cellÿsubset as a possible cause of autoimmune disease.J Exp/Med.1985,161:72~87.
4.SakaguchiS.RegulatoryTcells:keycontrollersofimmunologicself-tolerance.Cell.2000,101:455~458.
与癌共舞公众号及网站及APP上发表的文章及讨论仅代表作者或发帖人个人观点,不代表平台立场。
与癌共舞公众号文章经医学编辑和版主审核,具有明显谬误和不良引导的文章将禁止发表。




































热门跟贴