大豆分离蛋白(SPI)作为一种高营养的植物蛋白,因其良好的凝胶特性而在食品工业中得到广泛应用。热处理是SPI凝胶形成的关键步骤,加热过程中形成的蛋白质聚集体对凝胶的性质起着至关重要的作用。近年来不同的处理方式被用于增强SPI的凝胶性能并改善其凝胶网络,其中包括盐离子、酶、酸等处理。基于转谷氨酰胺酶(TG)、漆酶、葡萄糖氧化酶或某些内源性酶的处理是最常见的提升SPI凝胶特性的方法之一。
盐离子是影响SPI凝胶特性的重要因素之一,且盐离子种类也会对凝胶性质产生不同的影响。
北京工商大学食品与健康学院的曾祥权、彭琳琳、李健*等人为系统探究食品生产加工中常见的盐离子对TG交联SPI凝胶特性的影响,本研究选取了典型一价(Na+、K+)、二价(Ca2+、Mg2+、Fe2+)以及三价(Fe3+)金属盐离子作为外源增效剂,分析它们对TG交联SPI凝胶形成的促进作用及作用机制,旨在开发一种基于盐离子和TG协同作用的SPI凝胶双重改性技术,拓宽TG交联SPI凝胶未来在食品工业中的应用。

01
凝胶强度分析
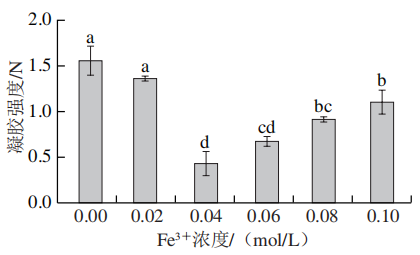
凝胶强度是反映蛋白质凝胶功能特性的重要指标。如图1所示,随着NaCl、KCl和MgCl2浓度增加,凝胶强度逐渐升高。当NaCl、KCl和MgCl2的添加量为0.1 mol/L时,凝胶强度分别为3.69、2.30、3.25 N,分别是对照组的2.43、1.51、2.32 倍。Zhao Hekai等发现在金属离子K+、Na+、Mg2+存在下有助于SPI纤维和更大纤维聚体的形成,从而促进凝胶的形成。而较低浓度(0.02 mol/L)的CaCl2和FeCl2使凝胶强度略微升高,但随着浓度升高凝胶强度逐渐下降。FeCl3的加入完全破坏了凝胶的结构,与对照组相比其凝胶强度都有所降低。Deng Chunyang等也发现蛋清蛋白凝胶的硬度随着Fe3+浓度的增加而降低,这可能是FeCl3加入后所形成的粗糙结构阻碍了蛋白分子在凝胶化过程中的聚集和交联,破坏了蛋白质凝胶网络的连续性,从而削弱了凝胶强度。






02
质构特性分析
如表1所示,NaCl、KCl和MgCl2浓度由0.02 mol/L增加到0.10 mol/L,凝胶的硬度、内聚性、弹性和咀嚼性整体显著上升。当离子浓度为0.10 mol/L时,Na+、K+和Mg2+处理组的SPI凝胶硬度分别是对照组的160.0%、272.6%、205.3%。在Liu Honglang等的研究中也可以观察到相似的结果,Na+、K+、Ca2+的少量加入可以促进蛋白质分子的结合从而提升印加花生蛋白凝胶的硬度。此外,如表1所示,CaCl2的加入使凝胶硬度和弹性略有上升,但随浓度升高又有所下降。FeCl2和FeCl3的加入使得凝胶的硬度和弹性显著降低,严重破坏了SPI原有的结构。研究表明,Fe3+可以改变蛋白质的构象,使一些分子链失去柔韧性,导致凝胶抵抗机械压缩的能力变差,与本研究的结果一致。


03
WHC分析
WHC作为评价凝胶加工特性的指标,能够反映凝胶对水的结合能力以及凝胶网络结构的均匀性和致密程度。如图2所示,NaCl、KCl和MgCl2的加入使得凝胶WHC逐渐上升,随着浓度的增加,样品的WHC接近100%,Liu Honglang等发现添加低浓度的Na+、K+使印加花生蛋白的WHC显著增加,盐离子的加入可优先与水分子结合形成氢键,使凝胶基质中的水结合更强从而增加WHC。而CaCl2、FeCl2和FeCl3的加入使WHC不稳定且与空白相比有所下降,这些离子的加入破坏了原有的结构使其与水结合的能力下降,从而降低其WHC。Wang Xufeng等证明了凝胶的结构在决定水分保留方面起着至关重要的作用,强而均匀的凝胶结构使凝胶基质内的水被更紧密地包裹。总地来说,SPI凝胶WHC的提高,归因于Na+、K+、Mg2+的加入提高了复合凝胶的凝胶强度和结构特性,形成了更稳固的结构,与水分子的结合也更加紧密。

基于凝胶强度、质构特性和WHC分析,NaCl、KCl和MgCl2均显著增强了TG交联SPI凝胶的凝胶强度、质构性能和WHC。相比之下,其他金属盐的处理则导致凝胶结构遭到破坏,其各项性能指标均有所下降。采用0.1 mol/L Na+、K+和Mg2+处理可以形成具有高凝胶强度和WHC的SPI凝胶。因此,后续的研究中,选择0.1 mol/L Na+、K+和Mg2+作为双重修饰技术的实验参数,进一步深入研究它们对TG交联SPI凝胶形成过程的提升作用机制。
04
流变特性分析
凝胶的流变特性对于其加工和储存至关重要。G’和G”分别用于评估凝胶的弹性和机械强度。如图3所示,所有凝胶样品的G’均大于G”,表明凝胶体系以弹性特征为主导,这可能与形成较强的凝胶结构有关。与对照组相比,添加3 种盐离子的实验组均表现出更高的G’和G”值,且各样品均呈现轻微的频率依赖性,这种特性与凝胶体系中疏水和氢键相互作用有关。具体而言,引入Na+、K+和Mg2+后,G’和G”值也呈现出不同程度的提升,这是由于盐离子通过静电屏蔽效应促进了蛋白质分子的聚集,从而形成了更为致密和稳定的凝胶网络结构。本研究流变特性的结果与凝胶强度和质构分析的结果相印证,进一步证实了添加上述盐离子促进了SPI分子形成了更致密的凝胶结构。

05
分子对接分析
为探究盐离子对TG交联SPI凝胶形成的促进作用是基于其对TG催化活性的影响还是离子对TG交联后SPI分子结构的影响,使用AutoDock软件进行盐离子与TG的分子对接分析。通常认为,当配体和受体的预期结合能在-5~-15 kcal/mol范围内时,配体具有稳定的结合亲和力,且结合能越低,配体与受体的结合亲和力越强。结果显示,Na+、K+、Mg2+与TG受体分别形成4、5、5 组配位键,其非共价结合能接近,依次为-4.199、-4.284、-4.284 kcal/mol,高于-5 kcal/mol(图4)。这说明盐离子与TG之间仅存在微弱的非共价结合,但并不足以对TG的活性产生明显影响。因此,推测盐离子可能通过直接影响TG交联后的SPI结构以促进其凝胶特性提升,后续将从蛋白质结构维度(表面疏水性、Zeta电位和粒径、亚基结构、二级结构、水分分布等)分析盐离子对TG交联SPI凝胶形成的促进机制。

06
H0分析
H0可以反映蛋白质结构的展开程度和暴露的表面疏水性基团数量。TG能够介导蛋白质疏水末端残基与(由蛋白水解暴露的)疏水侧链之间的结合,进而促使蛋白分子聚集形成凝胶结构,这些凝胶结构会包围疏水基团,从而降低其疏水性。由图5可知,与对照组相比,添加盐离子的凝胶H0均显著下降,说明它们之间存在疏水相互作用,其中NaCl和MgCl2处理组分别下降了50.1%、35.2%。Xue Hui等研究发现NaCl的添加可降低卵清蛋白分子的去折叠程度,导致其表面暴露的疏水基团减少,进而使卵清蛋白凝胶的H0下降。此外,还有研究发现H0的下降是由于蛋白质聚集体的形成引起的,通过增强蛋白质与蛋白质分子间疏水相互作用,覆盖了蛋白质表面的疏水位点,进一步阻碍了与ANS荧光探针的结合,导致荧光强度下降。因此,推断这些盐离子的加入能够促进蛋白分子的聚集,从而使其形成更稳定的蛋白凝胶结构。

07
Zeta电位和粒径分析
Zeta电位是悬浮固体颗粒和液相之间剪切平面上的电位,其绝对值可表征悬浮溶液的稳定性。如图6A所示,NaCl、KCl和MgCl2的添加显著提高了TG交联SPI凝胶体系的Zeta电位绝对值,分别为对照组的140.6%、155.4%和173.2%。MgCl2组凝胶的Zeta电位显著高于其他组,说明Mg2+可产生更强的静电屏蔽,且诱导生成的凝胶稳定性最强。Fan Shengyu等研究了不同盐离子对多糖-蛋白复合物特性的影响,发现适当浓度的Na+和K+可显著提高体系的Zeta电位绝对值,它们通过与酪蛋白中带正电荷的反应性基团发生竞争,并吸附在多糖的侧链上,从而形成更稳定的复合物。因此,3 种盐离子具有增强SPI凝胶稳定性的作用。
蛋白质在凝胶中的降解和聚集可以通过粒度实现可视化。由图6B可知,3 种盐离子的添加显著提高了复合凝胶体系的平均粒径。其中,NaCl、KCl和MgCl2处理组的平均粒径分别为对照组的1.17、1.06、1.12 倍。这表明盐离子的引入能够显著诱导蛋白质颗粒发生聚集现象,促进更大聚集体的形成,从而导致颗粒粒径增大。在相同浓度下,由于Na+的静电屏蔽效果弱于K+,导致Na+处理的凝胶体系静电排斥力相对较强,因此其形成的颗粒粒径大于K+处理的凝胶体系。基于上述研究可以得出,离子处理引起复合凝胶粒径的增加可能是由于它们对蛋白质分子聚集的促进作用。


08
内源荧光光谱分析
荧光光谱的改变可以反映蛋白质分子周围构象和极性的变化。Wu Chao等研究表明,热处理能够引起蛋白质三级结构的扩展以及反应性基团的暴露,促进蛋白质分子的聚集。如图7所示,经过盐离子处理后,TG交联的SPI凝胶固有荧光强度均显著降低,同时最大荧光发射波长(λmax)出现不同程度的红移,表明处理后其构象都发生了变化。荧光强度的降低表明凝胶体系中蛋白质聚集体的形成。结合H0、Zeta电位和粒径分析的相关结果,不同盐离子的加入促进了蛋白分子的聚集,色氨酸残基被埋藏,使空间结构变得更加紧凑和稳定,最终降低了复合凝胶体系的荧光强度。

09
FTIR分析
FTIR可以揭示蛋白质侧链上的局部环境和官能团之间的相互作用。如图8A所示,酰胺A带(3 200~3 500 cm-1)、酰胺I带(1 600~1 700 cm-1)和酰胺II带(1 500~1 600 cm-1)处的吸收峰分别反映了分子间氢键以及O—H键和N—H键的拉伸振动、C=O键的拉伸振动和N—H键平面弯曲振动、C—N键拉伸振动。与对照组相比,经过外源因子处理的蛋白凝胶光谱与酰胺A带相关的峰出现红移(从3 285.77 cm-1移动至3 281.29~3 282.73 cm-1)有关。结果表明,SPI酰胺A带中的—OH或—NH与部分外源因子中的—OH、—C=O、—C—O—C—或—COOH基团之间发生了氢键或共价相互作用(如酯键和酰胺键的形成)。因此,盐离子促进SPI分子之间的氢键或共价相互作用可能在诱导高凝胶强度SPI凝胶形成的过程中起到了关键作用。
酰胺I带(1 600~1 700 cm-1)在FTIR中提供了蛋白质二级结构最重要的信息。为进一步研究蛋白质二级结构的变化,对酰胺I带范围进行了分峰拟合。通常,1 600~1 639、1 640~1 650、1 651~1 660 cm-1和1 661~1 700 cm-1处的峰分别对应于β-折叠、无规卷曲、α-螺旋和β-转角。α-螺旋通过多肽链中羰基氧原子(—CO)和氨基氢原子(NH—)之间形成的分子内氢键稳定。β-折叠与蛋白质分子的聚集程度相关,其含量的增加表明蛋白质分子之间的聚集程度增加,且是蛋白质聚集和凝胶形成的基础。β-转角由极性和带电荷的氨基酸残基组成,与蛋白质的亲水性有关。如图8B所示,与对照组相比,盐离子处理组的β-折叠含量上升,α-螺旋和无规卷曲的含量都有所下降。Li Jian等发现盐离子可促进蛋黄低密度脂蛋白中α-螺旋和无规卷曲结构减少,β-折叠增加。β-折叠的伸展构象形成高密度分子间氢键网络,并通过肽链紧密堆积增强范德华力(尤其是疏水作用),从而强化蛋白分子的交联。同步减少的α-螺旋/无规卷曲则降低蛋白链柔韧性,此效应与β-折叠的刚性贡献协同,共同提升凝胶性能。与此同时,盐离子引入导致的这些结构变化可以促进蛋白分子之间的氢键、范德华力和疏水相互作用等分子间相互作用,从而推动蛋白分子的重排和凝胶结构的形成。因此,3 种盐离子的加入可以通过改变SPI分子的二级结构,增强其分子间的相互作用,进而促进TG交联SPI凝胶形成更加稳定和致密的结构。



10
SDS-PAGE分析
SPI主要包括 2S、7S、11S、15S 4 个组分,其中β-伴大豆球蛋白(7S)和大豆球蛋白(11S)两个组分占70%以上,而2S和15S两个组分蛋白约占10%。7S是由α’、α和β亚基组成的三聚体糖蛋白,其分子质量分别约为80、70 kDa和50 kDa;而11S是由酸性亚基A(35~41 kDa)和碱性亚基B(20 kDa)组成的六聚体糖蛋白。如图9所示,添加盐离子后没有出现新条带,也未观察到原有条带的消失,这表明盐离子的添加并未导致新蛋白质亚基的形成。NaCl和KCl处理组对蛋白质图谱条带的深浅无明显影响,而MgCl2处理组则显著降低了7S条带强度。Abedi等通过研究发现NaCl会影响醇溶蛋白和谷蛋白的分子构象,而对这些蛋白质的分子质量没有显著影响,与本实验的结果相似。Wu Chao等研究发现具有较高11S比率的SPI能形成更强的凝胶网络结构。因此,Mg2+的加入可能在一定程度上能够增强SPI凝胶的网络结构。

11
LF-NMR和MRI分析
T2表示样品的自旋弛豫时间,可提供凝胶体系中水分子结合状态和迁移率的关键信息,也间接表征了水分子和溶质分子之间的相互作用,能够为评估凝胶网络的完整性提供关键数据。如图10A所示,所有组别均可观察到4 个不同的T2分布峰,这些水的状态包括强结合水(T2b)、弱结合水(T21)、不易流动水(T22)和自由水(T23)。与对照组相比,添加3 种金属离子后,T2b的出现时间提前,表明适量盐离子促进了氢质子交换,增强了凝胶基质与水分子之间的相互作用,使更多的水分子固定在蛋白极性基团上,增强了水合作用,降低了凝胶内部的水分流动性,从而提升了持水性能,与WHC的分析结果一致。另外,T22峰宽减小(图10A),表明不易流动水空间分布更均匀,如图10B所示,MgCl2的加入使不易流动水升高44.4%,与其他两种离子相比变化更明显,表明MgCl2可介导“离子桥联”作用的产生,形成更致密的凝胶网络,将水分更充分“锁”在凝胶内部。
MRI作为一种非破坏性检测技术,能够精确反映样品中水分分布的差异。在MRI图像中,可以观察到蛋白凝胶中不易流动水和自由水的分布情况。如图10C所示,颜色条带由红色变为绿色再变为蓝色,直观地反映了氢质子密度的递减趋势,即凝胶的含水量逐步降低。对照组几乎呈现全红,说明存在大量的游离水,而盐离子的加入使红色区域逐渐减少,黄色、绿色的面积越来越大,表明复合体系中水与凝胶基质之间逐步结合得更加牢固,促进凝胶体系中水分流动性降低、水分分布更加均匀。该研究结果与LF-NMR的结果相印证,证实不同盐离子处理降低了凝胶中水分的流动性,同时也解释了处理组相比对照组具有高WHC的原因。




12
SEM分析
SEM可评估不同盐离子对TG交联SPI凝胶微观结构的影响。如图11所示,对照组与经盐离子处理的蛋白凝胶之间的微观结构存在显著差异,对照组呈现松散的网络结构,其凝胶颗粒分布不均匀且孔隙较大,相比之下,处理组样品显示出更为致密的微观结构,呈现出致密的堆叠聚集体结构。这种现象可能归因于盐离子与SPI的相互作用从而填充了凝胶中的孔隙,导致形成更细纤维、更小孔隙的致密网络。以往的研究表明,盐诱导的致密、有序微观结构的凝胶网络可以基于毛细作用力束缚更多水分,从而拥有更高的持水性。因此,扫描电镜分析与SPI凝胶WHC分析结果相印证。

13
结 论
本研究通过比较不同金属盐(NaCl、KCl、CaCl2、MgCl2、FeCl2和FeCl3)对TG交联SPI凝胶形成的影响,发现0.1 mol/L NaCl、KCl和MgCl2处理可以形成具有高凝胶强度和WHC的SPI凝胶。因此,进一步采用该浓度下NaCl、KCl和MgCl2 3 种金属盐对TG交联SPI进行处理,阐释3 种盐离子对TG交联SPI凝胶形成的提升作用机制。如图12所示,基于流变学分析,3 种盐离子处理组的G’和G”均显著高于对照组,且表现出轻微的频率依赖性。分子对接实验的结果表明盐离子可能通过直接影响TG交联后的SPI结构以促进其凝胶特性提升。进一步研究发现,处理组样品的H0和荧光强度均有所下降,Zeta电位绝对值和平均粒径显著提高。盐离子可诱导SPI凝胶中β-折叠含量上升,而α-螺旋和无规卷曲的含量减少。根据LF-NMR、MRI和SEM分析,盐离子处理降低了SPI凝胶中水分的流动性,且盐离子处理组SPI凝胶微观结构呈现致密的堆叠聚集体。综合以上结果,不同盐离子的加入促进了TG交联SPI分子的聚集和有序二级结构的形成,提升凝胶中结合水的含量,使空间结构变得更加紧凑,生成高稳定性和凝胶强度的SPI凝胶。因此,本研究结果为拓展Na+、K+和Mg2+在高性能SPI基凝胶制备中的应用范围奠定了一定理论基础。基于3 种盐离子复合TG处理制备得到的SPI凝胶可被用在不同含水量的植物蛋白产品中,包括植物酸奶,植物火腿、即食豆干和植物肉块等。其中,MgCl2-TG复合处理得到的凝胶综合表现比较均衡,可在高含水量、需要顺滑口感的液体或半固体产品(如植物酸奶、涂抹奶酪)的加工中使用,KCl-TG复合处理得到的凝胶可替代Na+用于低钠标签植物火腿的生产中,而NaCl-TG复合处理得到的凝胶硬度最高,则适合生产低水分、耐咀嚼的植物肉块和即食豆干。

作者简介
通信作者

李健 教授
国家高层次人才特殊支持计划青年拔尖人才,全国粮食和物资储备青年拔尖人才,北京市属高校青年拔尖人才,博士生导师。北京工商大学食品与健康学院副院长,中国轻工业植物基食品绿色低碳加工技术重点实验室主任、北京食品学会副理事长、中国绿色食品协会绿色农业与食物营养专业委员会副秘书长、 中国食品工业协会营养指导委员会副秘书长、植物性食品产业联盟副秘书长、中国粮油学会粮油营养分会理事、全国农产品购销标准化技术委员会委员、全国肉禽蛋制品标准化技术委员会畜肉制品分技术委员会委员、国家食物营养教育示范基地专家工作委员会委员、长城食品安全科学技术奖专家委员会专家、《食品工业科技》青年编委、科普中国专家、“中国食品行业智库”专家成员。获山东省科技进步二等奖及中国商业联合会科技进步一等奖等重要奖项共计7 项。主持国家自然科学基金面上项目2 项,十四五重点研发计划重点专项1 项,国家卫生健康委政府购买服务2 项,企业委托项目4 项。发表学术论文50余篇,获专利授权30余项。
第一作者

曾祥权 讲师
北京工商大学
中国食品药品质量安全促进会特色食品与智慧团餐专委会副秘书长、国际食品安全与营养健康高峰论坛组委会副秘书长,“科创中国”食品营养与安全产业科技服务团及中国轻工业植物基食品绿色低碳加工技术重点实验室成员兼联系人,《Foods》特刊客座编辑,《Food and Medicine Homology》青年编委,《Trends in Food Science and Technology》、《Critical reviews in Food Science and Nutrition》、《Food Chemistry》、《Food Hydrocolloids》、《食品科学》和《食品研究与开发》杂志审稿人。入选第十届中国科协青年人才托举工程,研究方向为植物基食品加工,主持“十四五”国家重点研发项目子课题、国家农业重大科技攻关项目子课题、北京市自然科学基金等项目共12 项,发表国内外学术论文30余篇,其中第一作者/通信作者身份发表SCI论文23 篇,EI论文2 篇及中文核心论文5 篇,获北京高校教师教学创新大赛优秀奖1项,授权专利2 项,参与制定国家及团体标准2项。
引文格式:
曾祥权, 彭琳琳, 赵美婷, 等. 不同盐离子对转谷氨酰胺酶交联大豆分离蛋白凝胶特性的提升机制[J]. 食品科学, 2025,46(22): 145-156. DOI:10.7506/spkx1002-6630-20250610-069.
ZENG Xiangquan, PENG Linlin, ZHAO Meiting, et al. Mechanisms of action of different salt ions in improving the gel properties of transglutaminase cross-linked soybean protein isolate[J]. Food Science, 2025, 46(22): 145-156. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20250610-069.
实习编辑:刘芯;责任编辑:张睿梅。点击下方阅读原文即可查看全文。图片来源于文章原文及摄图网

























热门跟贴