白酒是中国传统蒸馏酒。因其不同的风味口感,白酒可分为12 种香型,其中浓香型白酒在白酒销售市场中占比最高,达到70%。浓香型白酒馥郁浓香、回味悠长,其呈味物质主要来源于微生物发酵中产生的有机酸、酯类、高级醇以及羰基化合物。白酒中风味物质的形成与酿造环境中微生物群落密切相关,而酵母菌作为其中的关键微生物,其作用不容忽视。
库德里阿兹威毕赤酵母(Pichia kudriavzevii),又称东方伊萨酵母,在自然界分布广泛,被广泛应用于白酒发酵过程。在前期研究中,本实验室筛选到一株高产酯化酶P. kudriavzevii,产酯酶能力为33.3 U/mL。同时发现,该菌和丁酸梭菌(Clostridium butyricum)在混菌发酵条件下产酯总量达到1.932 g/L,二者具有较好的协同产酯能力。
近年来,随着蛋白质组学技术的飞速发展,基于串联质谱标签(TMT)的定量蛋白质组学技术因其通量高、误差小、灵敏度高的优势,在蛋白质组学研究中广受欢迎。
四川轻化工大学生物工程学院的蔡岭肸、刘春艳、邹伟*等人以P. kudriavzevii作为研究对象,利用TMT定量蛋白质组学技术分析其单菌发酵、与C. butyricum混菌发酵之间的蛋白质组学差异。在蛋白水平上,系统解析单菌和混菌发酵时的生长代谢机制差异,以期为调控该混菌发酵系统提供一定理论参考。

1 单菌与混菌培养发酵产物分析




如图2所示,总体上,单菌发酵所产生的酸、醇、酯类代谢物质的产量低于混菌发酵。以乙醇为例,JM5-4单菌发酵产量在1.598 g/L,GD1-1单菌发酵产量为1.7 g/L,而混菌发酵却达到了2.396 g/L,几乎是JM5-4单菌发酵和GD1-1单菌发酵的1.50、1.41 倍。对于酸类物质,JM5-4单菌发酵产物主要是乙酸(产量为0.108 g/L),而与GD1-1混菌发酵后,乙酸的产量显著提升至0.425 g/L,约为JM5-4单菌发酵产量的4.0 倍。混菌发酵正丁酸和正己酸的产量分别为1.345 g/L和0.721 g/L,相较于GD1-1单菌发酵(正丁酸为1.042 g/L,己酸为0.679 g/L)分别提高了约29%和6%。JM5-4单菌发酵主要产乙酸乙酯(0.278 g/L),GD1-1单菌发酵为0.424 g/L,而混菌发酵乙酸乙酯产量为0.544 g/L,分别为单菌发酵的2.0、1.3 倍。并且在混菌发酵后,酯类物质更为丰富,总酯产量更高。意外的是,JM5-4在混菌发酵时产生了0.928 g/L的甲醇,是单菌发酵所没有的。推测是C. butyricum GD1-1产生该物质。甲醇作为GD1-1单菌发酵的产物时,其产量为1.407 g/L,明显高于混菌发酵,约为1.5 倍。因此,可以认为在混菌发酵条件下,对C. butyricum GD1-1甲醇的合成具有抑制作用。总体而言,将JM5-4与GD1-1进行混菌发酵,促进了代谢物产量,并使其代谢产物更加丰富。
2 蛋白质鉴定与定量分析

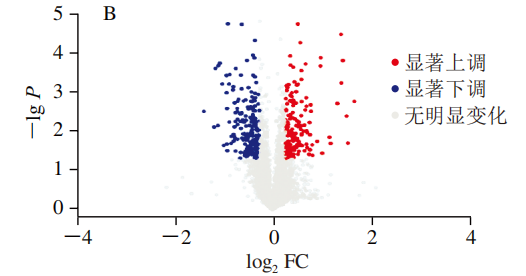


如图3A所示,二级谱图总数为532 875 张,数据库匹配蛋白谱图为56 168 张;肽段总数为22 220 个,唯一肽段总数为20 777 个;鉴定到的蛋白质总数为3 164 个,可定量蛋白有3 164 个。如图3B所示,以差异倍数(fold change,FC)>1.2且P<0.05为标准(显著下调的蛋白质以蓝色标注(FC<0.83且P<0.05),显著上调的蛋白质以红色标注(FC>1.2且P<0.05),无差异的蛋白质为灰色)筛选得到组间共有355 个差异表达蛋白(differentially expressed proteins,DEPs),包括上调蛋白159 个、下调蛋白质196 个。采用层次聚类算法对各组的DEPs进行相似性分析,如图3C所示,单菌发酵组(J)中DEPs上调与下调表达相似,混菌发酵组(JG)的DEPs表达相似;JG组内(JG1、JG2和JG3)以JG1与JG2差异表达相似度最高,J组内(J1、J2和J3)J1与J3差异表达相似度最高。
3 JM5-4全蛋白组学注释与分析
基于GO与KEGG注释,在JM5-4的单菌与混菌培养下,总共注释到3 164 个蛋白质信息,包括355 个DEPs、87 个代谢通路。






GO进行功能注释总共得到3 164 个蛋白、355 个DEPs,包含生物过程735 个(涉及细胞过程207 个、代谢过程207 个、生物调控67 个等),分子功能369 个(涉及催化活性160 个、结合功能148 个、结构分子活性25 个等)和细胞组分898 个(涉及细胞199 个、细胞组分196 个、细胞器162 个、细胞器组分89 个等)。采用Fisher精确检验对DEPs进行GO功能富集分析,结果如图4所示。柠檬酸循环、药物代谢过程、小分子代谢过程、细胞质大核糖体亚基、细胞质核糖体、烟酰胺腺嘌呤二核苷酸结合、氧化还原酶活性等定位蛋白质发生了显著变化。利用CELLO软件将鉴定到的DEPs进行亚细胞定位,有257 个蛋白被定位到8 个不同的细胞器。如图5所示,其分布于细胞质129 个、线粒体91 个、细胞核19 个、周质5 个、细胞膜9 个、胞外2 个和液泡、过氧化物酶体各1 个。





基于KEGG通路注释,355 个DEPs被注释到,结果如图6A所示,DEPs主要集于个关键的代谢通路,包括氧化磷酸化、辅因子的生物合成、三羧酸循环、糖酵解/糖异生等,对JM5-4的生长与代谢具有重要影响。对DEPs进行富集分析,结果如图6B所示。三羧酸循环、氧化磷酸化、果糖和甘露糖代谢、链霉素的生物合成以及新霉素、卡那霉素和庆大霉素的生物合成等重要通路发生了显著变化。如图6C所示,上调DEPs主要涉及通路包括三羧酸循环、乙醛酸与二羧酸代、硫辛酸代谢等,下调DEPs涉及的通路包括阿特拉津降解、细胞周期、硫胺素代谢、RNA聚合酶等。图6D展示了DEPs在各代谢通路中的分布情况。其中丙酮酸代谢通路共注释到7 个DEPs,氧化磷酸化通路注释到20 个DEPs,而三羧酸循环通路则注释到13 个DEPs。
4
P. kudriavzeviiJM5-4的代谢通路注释与分析
在糖酵解/糖异生途径中,参与代谢的4 种DEPs包括葡萄糖-6-磷酸异构酶(EC: 5.3.1.9)、果糖-1,6-二磷酸酶(EC: 3.1.3.11)、磷酸甘油酸变位酶(EC: 5.4.2.11)和乙醇脱氢酶(EC: 1.1.1.2)均表现为下调。同时,己糖激酶(EC: 2.7.1.1)、甘油醛-3-磷酸脱氢酶(EC:1.2.1.12)、丙酮酸脱氢酶(EC: 1.2.4.1)和醛脱氢酶(EC: 1.2.1.3)的DEPs则呈现上调状态。在三羧酸循环中,柠檬酸合酶(EC: 2.3.3.1)、乌头酸盐水合酶(EC:4.2.1.3)、富马酸水合酶(EC: 4.2.1.2)及苹果酸脱氢酶(EC: 1.1.1.37)等相关DEPs均上调。此外,在乙醛酸及二羧酸代谢过程中,羟基丙酮酸还原酶(EC: 1.1.1.81)和乙醛酸还原酶(EC: 1.1.1.79)等DEPs也全数上调。由此可以认为JM5-4的混菌发酵(JG组)能有效促进碳水化合物代谢。涉及氧化磷酸化路径的12 个DEPs,如NADH-醌氧化还原酶(EC: 7.1.1.2)、琥珀酸脱氢酶(EC:1.3.5.1)、细胞色素还原酶(EC: 7.1.1.8)、F型质子泵ATP酶(EC: 7.1.2.2)和细胞色素氧化酶(EC: 7.1.1.9)等均上调,而细胞色素c氧化酶(COX)4、COX17、ATP酶H+转运V0亚基A(ATPeV0A)和ATP酶H+转运V1亚基G(ATPeV1G)等4 个DEPs则下调。这表明JM5-4的混菌发酵对能量代谢具有显著的促进作用。在氨基酸代谢方面,涉及甘氨酸、丝氨酸和苏氨酸代谢、精氨酸生物合成、丙氨酸-天冬氨酸代谢以及半胱氨酸和蛋氨酸代谢的多个DEPs(如羟基丙酮酸还原酶(EC: 1.1.1.81)、丝氨酸-靛醇酸转氨酶(EC: 2.6.1.45)、丝氨酸-丙酮酸转氨酶(EC: 2.6.1.51)、乙酰谷氨酸激酶(EC: 2.7.2.8)、N-乙酰-γ-谷氨酰基磷酸还原酶(EC: 1.2.1.38))大部分呈现上调,仅少数(苏氨酸醛缩酶(EC: 4.1.2.48)和5-氨基左旋酸合酶(EC: 2.3.1.37))为下调,表明混菌发酵能有效地促进氨基酸代谢。再者,在脂质代谢方面,涉及甘油脂代谢和脂肪酸降解的DEPs(例如醛脱氢酶(EC: 1.2.1.3))均呈现上调。酯酶(如S-甲酰谷胱甘肽水解酶(SFGH)(EC: 3.1.2.12)、核糖核酸酶(EC: 3.1.26.4)和海藻糖磷酸酶(EC: 3.1.3.12))的DEPs也均呈现上调,表明混菌发酵对JM5-4的部分产酯酶活性具有积极作用。



基于所得的注释信息,绘制JM5-4(JG组)的代谢路径,如图7所示,代谢途径相关酶如表1所示,对通路中的DEPs进行标记,如表2所示。在糖酵解/糖异生途径中,相关酶上调DEPs与下调DEPs数量基本相当,这表明该途径所生成的丙酮酸等代谢产物并未受到混菌培养(JG组)的显著影响。随后,在丙酮酸脱氢酶(EC: 1.2.4.1)的催化下,丙酮酸被转化为乙酰辅酶A,并生成二氧化碳。同时,该酶的DEPs表现为上调,促进了乙酰辅酶A的大量积累。乙酰辅酶在乙酰辅酶合成酶(EC: 6.2.1.1)的催化下转化为更多的乙酸,又在乙酰谷氨酸激酶(EC: 1.2.1.3,DEPs上调)的催化下加速了乙醛与乙酸的合成。然而,由于乙醇脱氢酶(EC: 1.1.1.2)的DEPs下调,可能会对乙醇和乙醛的合成产生一定的消极影响。在柠檬酸循环中,所有相关酶的DEPs均表现为上调,促进了通路中的代谢产物生成,进而在碳水化合物代谢中发挥了关键作用,参与细胞呼吸和能量生成过程,有效促进了细胞代谢的进行。丙酮酸在丙酮酸羧化酶(EC: 6.4.1.1)的催化下转化为草酰乙酸,进而通过2-异丙基丙二酸合成酶(EC: 2.3.3.1,DEPs上调)的催化,生成大量柠檬酸。同样地,在相关酶(DEPs上调)的催化下,混菌培养(JG组)中JM5-4的代谢产物(如顺势乌头酸、异柠檬酸、乙醛酸、草酰琥珀酸、戊二酸、琥珀酸、富马酸及苹果酸)相较于单菌培养(J组)均显示出一定的提升,并伴随CO2产量的增加,在发酵过程中产生大量气体。此外,JG组与J组相比,由其他酶(DEPs无明显变化)催化生成的代谢产物在数量上无显著差异。
另外,根据代谢通路,甲基草醛在D-乳酸脱水酶(EC: 4.2.1.130)的催化下能够代谢生成D-乳酸,而乙酰辅酶A在高柠檬酸合酶(EC: 2.3.3.14)的催化下生成高柠檬酸,但这些物质在前期实验中并未被检测到。同样,尽管在前期实验中能够检测到JM5-4代谢生成的丁二醇与16酸,但测得其在发酵液中的含量较低。因此,可以推测乳酸和高柠檬酸在发酵液中的含量过低,由于误差存在导致未能被检测出。
浓香型白酒的生产依赖于多种微生物的共同参与,其代谢产物是白酒风味的主要来源,不同微生物之间的相互作用能显著影响白酒的品质。目前,混菌发酵成为白酒领域的热门话题,与单菌发酵相比,多菌株混合发酵能显著增强白酒的风味。例如,在豉香型白酒中引入P. anomala和Lactobacillus plantarum混合发酵,能有效增强其风味;利用P. kudriavzevii和Saccharomyces cerevisiae混合发酵能显著提高浓香型白酒发酵中其他微生物的乳酸耐受性。将S. cerevisiae和Wickerhamomyces anomalus以特定比例混合发酵,能显著提高酱香型白酒中乙酸乙酯的含量。然而,当前的研究主要集中在混菌发酵对风味成分的影响,尚未深入探讨产酯酶菌株在混菌发酵中的代谢变化机制。本研究将产酯酶的菌株P. kudriavzevii与产己酸的菌株C. butyricum进行混菌发酵,并利用TMT定量蛋白质组学技术对JM5-4进行分析。结果表明,与单菌发酵相比,JM5-4在混菌发酵过程中的生长与代谢能力显著提升,其产酯酶能力也有所增强。
JM5-4在混菌发酵过程中,三羧酸循环和二羧酸及乙醛酸循环相关酶的全部DEPs表达上调,有效提升了其生长代谢水平和繁殖能力。伴随着代谢流速的提高,JM5-4对底物(如糖类)的转化利用效率也得到了强化,同时促进了二次代谢物(有机酸、香味物质等)的合成。值得注意的是,高浓度的有机酸可能导致质子与阴离子平衡的破坏,从而影响细胞膜、核糖体RNA、DNA以及酶的功能,从而阻碍微生物的正常生长和代谢。
P. kudriavzevii JM5-4展现出良好的酯酶合成能力。在混菌发酵后,部分酯酶相关DEPs的表达上调,从而显著提升了酯酶的合成能力。酯酶能够催化脂肪酸和醇的转化生成酯类化合物,酯酶的上调可能增强香气成分的合成,从而影响白酒的质量。核糖核酸酶(EC: 3.1.26.4)是一种磷酸单酯水解酶,具有修饰基因的功能,能影响各种类型的编码和非编码RNA的成熟。在细胞的多种生物过程中发挥关键作用,包括DNA的复制、修复以及RNA的处理。JG组涉及核糖核酸酶的DEPs上调,表明混菌发酵能促进核糖核酸酶的合成,加速细胞代谢。海藻糖-6-磷酸磷酸酶(EC: 3.1.3.12)能催化水解反应去除磷酸基团,形成海藻糖。该酶的DEPs上调,表明混菌发酵促进海藻糖磷酸酶的合成,从而催化多糖合成与能量代谢。SFGH(EC: 3.1.2.12,酯酶D)是一类能够水解羧酸酯键的酶,具有多态性,能催化S-甲酰谷胱甘肽水解成甲酸盐和谷胱甘肽,对含有硫酯键和酯键的底物具有更广泛的酯酶活性。研究表明,SFGH在真核生物和原核生物的甲醛解毒中发挥作用,被认为参与谷胱甘肽依赖性甲醛氧化途径。本研究发现,JG组涉及SFGH的DEPs全部上调,可能意味着混菌发酵会加速SFGH的合成,从而促进甲酸盐与谷胱甘肽的生成、催化谷胱甘肽依赖性甲醛氧化,以降低环境来源或甲醇代谢产生的甲醛含量。在酿酒发酵过程中,微生物代谢产生过多的甲醇及甲醛含量会影响白酒的良好风味品质,而SFGH的合成可很好地解决这一问题,表明混菌发酵能减少白酒酿造过程中所产生的有害物质,为白酒的质量控制提供一定理论基础。
结论
P. kudriavzevii JM5-4单菌发酵(J组)与混菌发酵(JG组)总共鉴定到3 164 个蛋白,355 个DEPs,其中包括糖酵解/糖异生(己糖激酶、甘油醛-3-磷酸脱氢酶、丙酮酸脱氢酶、醛脱氢酶)、三羧酸代谢(柠檬酸合酶、乌头酸盐水合酶、富马酸水合酶、苹果酸脱氢酶等)、乙醛酸和二羧酸代谢(羟基丙酮酸还原酶、乙醛酸还原酶等)在内的DEPs全部上调,表明该菌在混菌发酵条件下其生长代谢能力显著提升,还能促进酸类物质的合成。核糖核酸酶与海藻糖磷酸酶的大量合成同样促进了菌株细胞代谢与能量代谢。此外,SFGH的大量合成促进了甲酸盐与谷胱甘肽的生成,加速甲醛的氧化,能显著提升白酒的风味品质与安全。综上,本研究为探究白酒酿造过程中混菌发酵的代谢机制及其对风味品质的影响提供了一定的理论方法,对未来的应用与研究方向具有积极的推动作用。后续研究可以聚焦于优化这些代谢途径在实际酿造过程中的应用,以进一步提升白酒的风味特性和整体品质。
本文《串联质谱标签定量蛋白质组学解析产酯酶
Pichia kudriavzevii混菌发酵代谢机制》来源于《食品科学》2025年46卷第16期165-174页,作者:蔡岭肸 ,刘春艳 ,郑佳 ,张楷正 ,苏建 ,邹伟。DOI:10.7506 / spkx1002-6630-20250218-073。点击下方 阅读原文 即可查看文章相关信息。
实习编辑:王雨婷;责任编辑:张睿梅。点击下方阅读原文即可查看全文。图片来源于文章原文及摄图网

























热门跟贴